Når du markedsfører en medicinsk enhed, skal du have clearance fra Food and Drug Administration (FDA). Det er en streng proces, og der er betydelige gebyrer. Medicinsk udstyr falder under 3 klasser, og de nødvendige indlæg afhænger af hvilken klasse din enhed er tildelt. Oplysninger, der er relevante for FDA-godkendelsesprocessen, er opdelt i afsnittene nedenfor, så du let kan følge trinene.
Steps
-
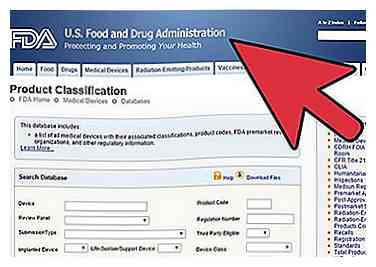 1 Bestem klassificeringen af din medicinske enhed.
1 Bestem klassificeringen af din medicinske enhed. - Der er 3 klasser: Klasse I, II og III. De er klassificeret på baggrund af risiko, idet klasse I er den laveste og klasse III er den største.
- Du vil finde ud af, hvad FDA forud for markedsføring kræver, baseret på klassificering af din enhed. Generelle kontroller er tildelt som klasse I enten med eller uden undtagelser. Generelle kontroller og særlige kontroller er tildelt som klasse II enten med eller uden undtagelser. Generelle kontroller og godkendelse forud for markedet er tildelt som klasse III.
- Hver enhed har et reguleringsnummer. Du skal bruge dette nummer til at bestemme klassificeringen af din enhed. Gå til database på webstedet http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfpcd/classification.cfm.
- Søg efter en del af navnet på din medicinske enhed, eller hvis du kender medicinsk specialitet, skal du indtaste det, hvor det står Device Panel.
-
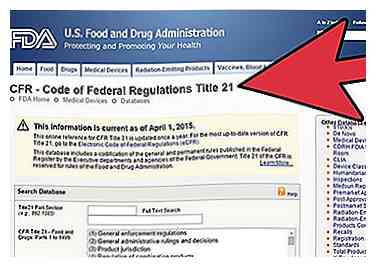 2 Søg efter regulering for din enhed, efter at du har fundet ud af enhedspanelet på CFR eller Code of Federal Regulation Titel 21.
2 Søg efter regulering for din enhed, efter at du har fundet ud af enhedspanelet på CFR eller Code of Federal Regulation Titel 21. - Gå til CFRs søgeside på http://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfCFR/CFRSearch.cfm.
- Læs oplysninger om regulering som generel bestemmelse, emballering og mærkning og andre relevante oplysninger om CFR.
-
 3 Find ud af, om du kan få FDA clearance for at markedsføre din medicinske enhed.
3 Find ud af, om du kan få FDA clearance for at markedsføre din medicinske enhed. - Hvis din enhed falder under klasse I eller II uden undtagelser, vil du blive pålagt en præmarked notifikation eller 510k til markedsføring.
- Hvis din enhed falder under klasse III, vil du blive pålagt en forudgående godkendelse eller PMA, medmindre det er en forudindstillingsenhed (som betyder på markedet før ændringsdokumentet for medicinsk udstyr i 1976 eller en tilsvarende enhed). I så fald vil du blive påkrævet en 510K.
-
 4 Indsend din præmarked notifikation eller 510K hvis det kræves.
4 Indsend din præmarked notifikation eller 510K hvis det kræves. - For en liste over 510k formularer, gå til http://www.fda.gov/MedicalDevices/ og indtast søgeord "Pre-market Notification Form" på søgeværktøjet. Vælg linket til 510k anmeldelsesgebyrer, og du vil have mulighed for at vælge fra menuen alle nødvendige oplysninger til 510k indsendelsesprocessen.
-
 5 Indsend din ansøgning om markedsføringstilladelse eller PMA, hvis det er relevant.
5 Indsend din ansøgning om markedsføringstilladelse eller PMA, hvis det er relevant. - Gå til http://www.fda.gov/MedicalDevices/ og indtast søgeord "Pre-Market Approval" på søgeværktøjet. Vælg linket til Pre-Market Approval (PMA), og du bliver bedt om at komme til siden, hvor du kan indsende din ansøgning og få alle nødvendige oplysninger til PMA-processen.
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Bestem klassificeringen af din medicinske enhed.
1 Bestem klassificeringen af din medicinske enhed.  2 Søg efter regulering for din enhed, efter at du har fundet ud af enhedspanelet på CFR eller Code of Federal Regulation Titel 21.
2 Søg efter regulering for din enhed, efter at du har fundet ud af enhedspanelet på CFR eller Code of Federal Regulation Titel 21.  3 Find ud af, om du kan få FDA clearance for at markedsføre din medicinske enhed.
3 Find ud af, om du kan få FDA clearance for at markedsføre din medicinske enhed.  4 Indsend din præmarked notifikation eller 510K hvis det kræves.
4 Indsend din præmarked notifikation eller 510K hvis det kræves.  5 Indsend din ansøgning om markedsføringstilladelse eller PMA, hvis det er relevant.
5 Indsend din ansøgning om markedsføringstilladelse eller PMA, hvis det er relevant.