Børn og voksne er ofte fascineret af videnskab og kemi. En god måde at holde et publikum underholdt i et klasseværelse eller hjemme er at lave dit eget brint. Vand og syrer indeholder begge hydrogen, som du kan adskille til at producere ren hydrogengas. Du kan fjerne hydrogengas fra vand ved hjælp af elektricitet. Syrer er undertiden endnu nemmere at bruge, da mange syrer vil reagere med metaller som aluminium og frembringe hydrogengas. Bare husk at være forsigtig, hydrogengas kan eksplodere.
Første del af tre:
Elektrolyserende vand
-
 1 Hæld vand i en glasbeholder. Undgå at bruge plast eller metal til dette. Du vil køre en elektrisk strøm gennem vandet, der kunne smelte plast. Metal vil udføre denne strøm og kunne chokere dig, hvis du rører ved beholderen.[1]
1 Hæld vand i en glasbeholder. Undgå at bruge plast eller metal til dette. Du vil køre en elektrisk strøm gennem vandet, der kunne smelte plast. Metal vil udføre denne strøm og kunne chokere dig, hvis du rører ved beholderen.[1] - Hvis du ikke er bekendt med dette forsøg, start med en kop vand. Produktion af for meget hydrogen kan være farligt.
- Børn bør kun gøre dette eksperiment med en ansvarlig / kyndig voksen.
- Tilsæt en spiseskefuld salt til vandet for bedre resultater - salt hjælper med at lede den elektriske strøm.
-
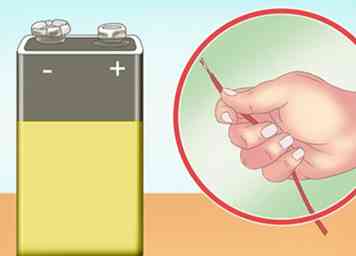 2 Find en strømkilde. Mens storskalig hydrogenproduktion kræver meget energi, kan dette eksperiment ske med lille input. Et 9V batteri er tilstrækkeligt til at udføre elektrolysen (opdeling af vandet i hydrogen og ilt). Du kan også bruge flere batterier i serie til at styrke effekten.[2]
2 Find en strømkilde. Mens storskalig hydrogenproduktion kræver meget energi, kan dette eksperiment ske med lille input. Et 9V batteri er tilstrækkeligt til at udføre elektrolysen (opdeling af vandet i hydrogen og ilt). Du kan også bruge flere batterier i serie til at styrke effekten.[2] - En bærbar strømforsyning er god til dette eksperiment, da dette eksperiment skal udføres udenfor eller under et dampapparat.
- Mens batterier ikke er generelt farlige, bør du stadig bære gummihandsker for at undgå at blive chokeret.
- 3 Tilslut et papirclips til hver terminal på batteriet. Dette vil danne en anode (den negative papirclips) og en katode (det positive papirclips). Sæt kun klipene i klemmerne på batteriet, indtil de er sikre.
-
 4 Sænk papirklemmerne. Når du sænker papirclipsne, strømmer strømmen fra anoden, gennem vandet og til katoden. Hydrogenbobler vil danne ved anoden, og katoden vil fremstille oxygen og chlorgas.[3]
4 Sænk papirklemmerne. Når du sænker papirclipsne, strømmer strømmen fra anoden, gennem vandet og til katoden. Hydrogenbobler vil danne ved anoden, og katoden vil fremstille oxygen og chlorgas.[3] - Vær forsigtig for ikke at røre sammen med clipsne.
Del to af tre:
Reagerer syre
-
 1 Placer aluminiumsfolie i et bægerglas. Rive stykker af aluminiumsfolie og læg dem i et bæger eller en anden beholder. Brug ikke en beholder med låg eller låg, da dette kan resultere i en eksplosion. Der er ikke behov for at måle mængden af anvendt aluminium.[4]
1 Placer aluminiumsfolie i et bægerglas. Rive stykker af aluminiumsfolie og læg dem i et bæger eller en anden beholder. Brug ikke en beholder med låg eller låg, da dette kan resultere i en eksplosion. Der er ikke behov for at måle mængden af anvendt aluminium.[4] - Du kan rive en tommer med tre tommer kvadrat aluminiumsfolie i stykker omkring tommelfingerens størrelse.
-
 2 Hold bægeret ventileret. Gør dette eksperiment udenfor eller under en dampplade. Væskegas spredes hurtigt, men er meget brandfarlig. En opbygning af hydrogengas, der udsættes for luften (eller enhver anden kilde til ilt) kan eksplodere.[5]
2 Hold bægeret ventileret. Gør dette eksperiment udenfor eller under en dampplade. Væskegas spredes hurtigt, men er meget brandfarlig. En opbygning af hydrogengas, der udsættes for luften (eller enhver anden kilde til ilt) kan eksplodere.[5] - Et eksempel på hydrogengas eksploderer er Hindenburg.
-
 3 Tilsæt saltsyre. Det er ikke nødvendigt at måle præcis mængden af saltsyre, der anvendes. Kloren i saltsyren vil reagere med aluminiumet for at danne aluminiumchlorid. Dette vil resultere i dannelse af hydrogengas.[6]
3 Tilsæt saltsyre. Det er ikke nødvendigt at måle præcis mængden af saltsyre, der anvendes. Kloren i saltsyren vil reagere med aluminiumet for at danne aluminiumchlorid. Dette vil resultere i dannelse af hydrogengas.[6] - Start med ca. 2 ounce saltsyre og tilsæt mere, hvis det er nødvendigt.
Del tre af tre:
Indsamling af hydrogenet
-
 1 Brug en ballon eller en flaske til at samle brintet. Placer åbningen af opsamlingsbeholderen (flaske eller ballon) over åbningen af dit reaktionsbæger eller beholder. Brintgassen er mindre tæt end luft og vil flytte op i dit opsamlingsbeholder. Denne metode bruges ofte til at sprænge en ballon til at demonstrere opadgående bevægelse af hydrogengas.[7]
1 Brug en ballon eller en flaske til at samle brintet. Placer åbningen af opsamlingsbeholderen (flaske eller ballon) over åbningen af dit reaktionsbæger eller beholder. Brintgassen er mindre tæt end luft og vil flytte op i dit opsamlingsbeholder. Denne metode bruges ofte til at sprænge en ballon til at demonstrere opadgående bevægelse af hydrogengas.[7] -
 2 Undgå at samle brint, når begge clipsene frigiver gas. Vandgas kan eksplodere, hvis den kommer i kontakt med ilt. Hvis du laver elektrolyse, skal du ikke forsøge at samle noget brint, når papirclipsne stadig udsender gas, da gassen vil være en blanding af hydrogen og ilt.[8]
2 Undgå at samle brint, når begge clipsene frigiver gas. Vandgas kan eksplodere, hvis den kommer i kontakt med ilt. Hvis du laver elektrolyse, skal du ikke forsøge at samle noget brint, når papirclipsne stadig udsender gas, da gassen vil være en blanding af hydrogen og ilt.[8] -
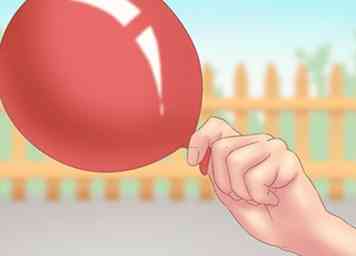 3 Indsamle kun små mængder. Du bør ikke samle eller opbevare et højt volumen af hydrogengas. Det udgør en alvorlig sikkerhedsrisiko og er svær at indeholde. Du bør kun gøre dette eksperiment til underholdning eller uddannelsesmæssige formål.[9]
3 Indsamle kun små mængder. Du bør ikke samle eller opbevare et højt volumen af hydrogengas. Det udgør en alvorlig sikkerhedsrisiko og er svær at indeholde. Du bør kun gøre dette eksperiment til underholdning eller uddannelsesmæssige formål.[9]
Facebook
Twitter
Google+
 Minotauromaquia
Minotauromaquia
 1 Hæld vand i en glasbeholder. Undgå at bruge plast eller metal til dette. Du vil køre en elektrisk strøm gennem vandet, der kunne smelte plast. Metal vil udføre denne strøm og kunne chokere dig, hvis du rører ved beholderen.[1]
1 Hæld vand i en glasbeholder. Undgå at bruge plast eller metal til dette. Du vil køre en elektrisk strøm gennem vandet, der kunne smelte plast. Metal vil udføre denne strøm og kunne chokere dig, hvis du rører ved beholderen.[1]  2 Find en strømkilde. Mens storskalig hydrogenproduktion kræver meget energi, kan dette eksperiment ske med lille input. Et 9V batteri er tilstrækkeligt til at udføre elektrolysen (opdeling af vandet i hydrogen og ilt). Du kan også bruge flere batterier i serie til at styrke effekten.[2]
2 Find en strømkilde. Mens storskalig hydrogenproduktion kræver meget energi, kan dette eksperiment ske med lille input. Et 9V batteri er tilstrækkeligt til at udføre elektrolysen (opdeling af vandet i hydrogen og ilt). Du kan også bruge flere batterier i serie til at styrke effekten.[2]  4 Sænk papirklemmerne. Når du sænker papirclipsne, strømmer strømmen fra anoden, gennem vandet og til katoden. Hydrogenbobler vil danne ved anoden, og katoden vil fremstille oxygen og chlorgas.[3]
4 Sænk papirklemmerne. Når du sænker papirclipsne, strømmer strømmen fra anoden, gennem vandet og til katoden. Hydrogenbobler vil danne ved anoden, og katoden vil fremstille oxygen og chlorgas.[3]  1 Placer aluminiumsfolie i et bægerglas. Rive stykker af aluminiumsfolie og læg dem i et bæger eller en anden beholder. Brug ikke en beholder med låg eller låg, da dette kan resultere i en eksplosion. Der er ikke behov for at måle mængden af anvendt aluminium.[4]
1 Placer aluminiumsfolie i et bægerglas. Rive stykker af aluminiumsfolie og læg dem i et bæger eller en anden beholder. Brug ikke en beholder med låg eller låg, da dette kan resultere i en eksplosion. Der er ikke behov for at måle mængden af anvendt aluminium.[4]  2 Hold bægeret ventileret. Gør dette eksperiment udenfor eller under en dampplade. Væskegas spredes hurtigt, men er meget brandfarlig. En opbygning af hydrogengas, der udsættes for luften (eller enhver anden kilde til ilt) kan eksplodere.[5]
2 Hold bægeret ventileret. Gør dette eksperiment udenfor eller under en dampplade. Væskegas spredes hurtigt, men er meget brandfarlig. En opbygning af hydrogengas, der udsættes for luften (eller enhver anden kilde til ilt) kan eksplodere.[5]  3 Tilsæt saltsyre. Det er ikke nødvendigt at måle præcis mængden af saltsyre, der anvendes. Kloren i saltsyren vil reagere med aluminiumet for at danne aluminiumchlorid. Dette vil resultere i dannelse af hydrogengas.[6]
3 Tilsæt saltsyre. Det er ikke nødvendigt at måle præcis mængden af saltsyre, der anvendes. Kloren i saltsyren vil reagere med aluminiumet for at danne aluminiumchlorid. Dette vil resultere i dannelse af hydrogengas.[6]  1 Brug en ballon eller en flaske til at samle brintet. Placer åbningen af opsamlingsbeholderen (flaske eller ballon) over åbningen af dit reaktionsbæger eller beholder. Brintgassen er mindre tæt end luft og vil flytte op i dit opsamlingsbeholder. Denne metode bruges ofte til at sprænge en ballon til at demonstrere opadgående bevægelse af hydrogengas.[7]
1 Brug en ballon eller en flaske til at samle brintet. Placer åbningen af opsamlingsbeholderen (flaske eller ballon) over åbningen af dit reaktionsbæger eller beholder. Brintgassen er mindre tæt end luft og vil flytte op i dit opsamlingsbeholder. Denne metode bruges ofte til at sprænge en ballon til at demonstrere opadgående bevægelse af hydrogengas.[7]  2 Undgå at samle brint, når begge clipsene frigiver gas. Vandgas kan eksplodere, hvis den kommer i kontakt med ilt. Hvis du laver elektrolyse, skal du ikke forsøge at samle noget brint, når papirclipsne stadig udsender gas, da gassen vil være en blanding af hydrogen og ilt.[8]
2 Undgå at samle brint, når begge clipsene frigiver gas. Vandgas kan eksplodere, hvis den kommer i kontakt med ilt. Hvis du laver elektrolyse, skal du ikke forsøge at samle noget brint, når papirclipsne stadig udsender gas, da gassen vil være en blanding af hydrogen og ilt.[8]  3 Indsamle kun små mængder. Du bør ikke samle eller opbevare et højt volumen af hydrogengas. Det udgør en alvorlig sikkerhedsrisiko og er svær at indeholde. Du bør kun gøre dette eksperiment til underholdning eller uddannelsesmæssige formål.[9]
3 Indsamle kun små mængder. Du bør ikke samle eller opbevare et højt volumen af hydrogengas. Det udgør en alvorlig sikkerhedsrisiko og er svær at indeholde. Du bør kun gøre dette eksperiment til underholdning eller uddannelsesmæssige formål.[9]